http://www.sciencehuman.com 科学人 网站 2015-10-10
新浪科技讯 北京时间10月7日消息,2015年度诺贝尔化学奖授予托马斯-林道尔(Tomas Lindahl)、保罗-莫德里奇(Paul Modrich)以及阿奇兹-桑卡(Aziz Sancar),以表彰他们在DNA修复机制方面的研究。

生命的奇迹时刻
从一个细胞到另一个细胞,从一代人到下一代人。决定着我们身体方方面面的基因信息千万年来在我们的体内传递着。尽管时常会遭受到来自周遭环境的各种攻击,但我们的基因仍显示出一种令人惊讶的稳定性。托马斯-林道尔、保罗-莫德里奇以及阿奇兹-桑卡三名科学家被授予2015年度的诺贝尔化学奖,他们的工作揭示了细胞如何进行DNA修复并确保其遗传信息安全的机制。
你的身份在来自精子的23条染色体和23条来自卵子的染色体相互结合的那一刻便已经被定义了。这些最初的信息共同组成了你的原始染色体版本,也就是你的遗传信息。
所有构建你所需要的信息都被包含在了其中。如果有人将你的第一个细胞中的DNA分子链抽取出来并拉直,它的长度将达到两米。
随着受精卵开始分裂,DNA分子也会被复制,分裂出来的新细胞将包含有与原始细胞完全一致的遗传信息。在那之后,分裂继续进行:两个变成四个,四个变成八个,在一周之后,你已经有128个细胞组成了,其中的每一个细胞内都包含着完整的遗传信息。此时你身体内全部的DNA分子链条长度即将接近300米长。
今天,在经过数十亿次的细胞分裂之后,你体内的DNA分子链条如果取出来拉直,其长度可以从地球抵达太阳再回到地球,来回大约250次。尽管你最初的DNA信息被复制了那么多次,但它的最新版本与最初受精卵中的原始版本之间的差异却极小。这里正是生命分子展示其伟大之处的时刻,因为从纯粹化学的角度来看,这样的事情几乎是不可能做到的。
所有化学过程都会发生随机误差。除此之外你的DNA分子每天还会受到有害辐射和其他分子相互作用的干扰或破坏。事实上,你应该在发育成胚胎之前就早已陷入化学上的完全混乱状态了。
你身体内的DNA物质受到一组蛋白质的监督。年复一年,我们的DNA完好程度惊人惊叹,这得益于一系列的分子修复机制的保护。这些蛋白质不断核查我们的遗传信息并修复任何发现的错误和损坏。2015年度诺贝尔化学奖的获奖人正是由于在分子层面上揭示了这一基本过程而获奖。他们的系统性工作为我们理解活的细胞如何运作作出了决定性贡献,并加深我们对于一些遗传性疾病、癌症以及衰老现象背后分子机制的了解。
托马斯-林道尔、保罗-莫德里奇和阿奇兹-桑卡各自独立地测定了人体内几种DNA修复机制过程。整个故事要从托马斯·林道尔说起,这位与阿尔弗雷德·诺贝尔同样来自瑞典的科学家。
既然生命存在——那么DNA必定是可以被修复的
“说实话,DNA的稳定性有多高?”1960年代末,托马斯·林道尔开始思考这个问题的答案。当时,科学界相信,作为构成生命现象的基础,DNA分子是极其稳定的,这几乎是毫无疑问的。进化的确需要突变的发生,但这样的突变在每一代都应该非常有限,因为如果遗传信息是不稳定的,那么任何多细胞生命都将不可能存在。在林道尔在美国普林斯顿大学做博士后研究期间,他针对RNA分子开展研究,这种分子是DNA分子的孪生姐妹。
但是事情并非一帆风顺。在实验中,林道尔必须加热RNA,但这样做就不可避免地会造成这种分子的迅速降解。RNA分子比DNA分子更加敏感,这一点是广为人知的,但如果RNA如此容易被加热破坏,DNA分子真的能够在一生的时间里都保持稳定吗?这个想法占据了林道尔的头脑。
数年后,林道尔开始着手探寻这个问题的答案,此时他已经回到瑞典,在斯德哥尔摩的卡罗琳学院任职。一些实验结果已经证明他的这种怀疑并非空穴来风:DNA分子会发生缓慢但明显的降解。林道尔估计认为每天都会发生数以千计对染色体造成破坏的伤害事件,这样的频率显然根本没有办法让人类在地球上存活下去。他从中得到的结论便是,必定存在某种能够修复所有这些DNA损伤的分子系统。有了这个想法之后,托马斯·林道尔开启了通往一扇通往全新研究领域的大门。
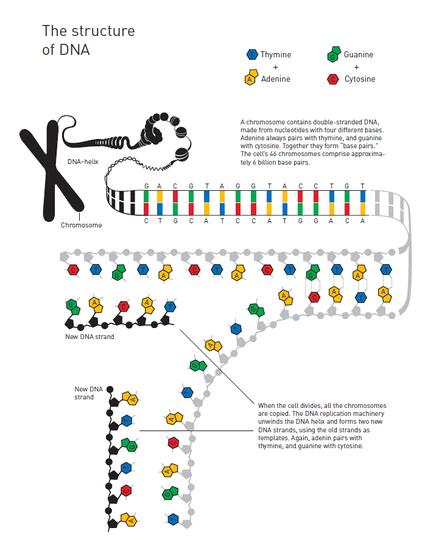
去除DNA损伤的特殊酶
林道尔选择使用细菌DNA开展相关研究,细菌DNA与人类DNA一样是由碱基为基础的几种核苷酸组成的。林道尔开始从中寻找修复酶。DNA的一处化学脆弱环节便是胞嘧啶非常容易丢失一个氨基团,从而造成遗传信息的改变。
在DNA双螺旋结构中,胞嘧啶总是与鸟嘌呤配对,但当这个氨基团缺失时,这个遭受破坏的区域往往就会与腺嘌呤相结合。于是,如果这个缺陷得以持续存在,那么在下一次遗传信息复制发生时,就将发生突变。林道尔意识到,细胞内部必定具备某种机制能够防止这样的事情发生。随后他成功地识别出一种细菌酶,其能够从DNA中清除那些遭受破坏的胞嘧啶。在1974年,林道尔发表了自己的研究成果。
林道尔和碱基切除修复机制
这是林道尔随后35年成功工作的开端,在此期间,林道尔发现并检查了细胞内部的多种DNA修复工具。在1980年代初,因种种机缘,他来到英国工作并在英国皇家癌症研究基金会任职。1986年,他成为新设立的克莱尔霍尔实验室(Clare Hall Laboratory)主管,该实验室后来以其科学创新能力而闻名。逐渐的,林道尔开始拼接起“碱基切除修复”分子机制的图景。这一DNA修复机制中涉及糖苷酶(glycosylases),这种酶与他在1974年发现的那种酶很相似。碱基切除修复同样发生在人体内。在1996年,托马斯·林道尔成功地在试管中重现了人体内的DNA修复机制。
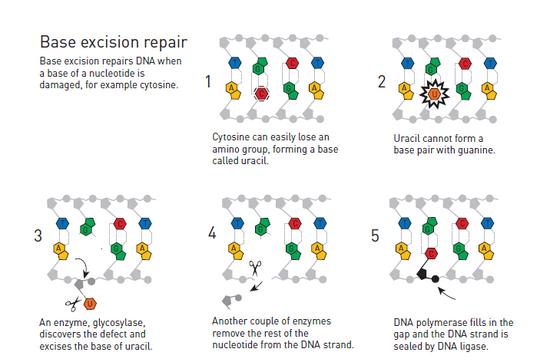
但林道尔也意识到,即便是处于细胞内的保护环境下,DNA分子仍然会不可避免的发生改变。长期以来,人们就已经知晓,一些环境因素,比如紫外线辐射都可能会造成DNA的损坏。而大部分细胞用于修复紫外线造成破坏的机制则是“核苷酸切除修复”机制,这是由出生于土耳其,而活跃于美国的阿奇兹·桑卡最先发现的。
做医生还是去学生物化学?
阿奇兹-桑卡对生命分子的迷恋是他在伊斯坦布尔大学攻读医学学位的时候发展起来的。在毕业之后,桑卡在土耳其做了几年医生,但在1973年他决定去学生物化学。有一种现象引起了桑卡的强烈兴趣:当细菌暴露在致命剂量的紫外线辐射中之后,再用蓝色可见光去照射它们,后者就能立刻恢复过来。桑卡对于这种神奇的现象非常好奇,从化学上看,这种事情究竟是如何出现的?
一个名叫克劳德-鲁普特(Claud Rupert)的美国人此前对这一现象开展过研究,于是阿奇兹·桑卡来到位于美国德克萨斯州达拉斯鲁普特的实验室开展研究。1976年,利用当时还相对粗糙的分子生物学工具,桑卡成功地克隆了修复紫外线DNA损伤的那种酶——光修复酶(photolyase)的基因信息,并成功地让细菌超量产生这种酶。这项工作也成为了他的博士毕业论文,但当时并未能引起人们的特别关注——他三次申请博士后研究职位都遭到了拒绝。在这样的情况下桑卡关于光修复酶的研究不得不暂时停了下来。为了继续开展对DNA修复机制的研究,阿奇兹-桑卡在耶鲁大学医学院找到了一份实验室技术员的工作,这是该领域的顶尖研究机构之一。在这里,桑卡开始了最终将让他获得诺贝尔化学奖的工作。
阿奇兹-桑卡——查明紫外线DNA损伤的细胞修复机制
当时事情已经很清楚,那就是细菌拥有两种修复紫外线DNA损伤的机制:除了需要依靠光照发生作用的光修复酶之外,还发现了第二种能够在黑暗中起作用的机制。阿奇兹-桑卡在耶鲁大学的新同事们从1960年代中期开始便一直在开展对这种黑暗中起作用机制的研究,他们借助的是三种对紫外线敏感的不同细菌,它们各自携带有不同的基因变异,分别命名为:vrA,uvrB 和 uvrC。
和此前开展对于光修复酶的工作一样,桑卡开始对这第二种黑暗中起作用的机制背后的分子化学机制进行调查。在几年之内,他便已经成功地识别、分离并描述了这种由vrA,uvrB 和 uvrC标示的酶。在一次突破性的试管实验中,桑卡证明了这种酶能够识别紫外线造成的DNA损伤,并会在DNA链条上进行两次切割,分别在受破坏片段的上方和下方,从而去除整个受破坏的DNA片段,其中大约包含了12~13个核苷酸。
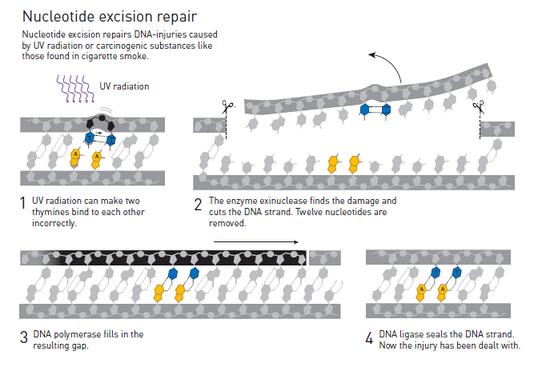
人体与细菌体内相似的紫外线损伤修复机制
阿奇兹-桑卡揭示这种修复机制背后分子层面细节的能力改变了整个研究领域。他在1983年发表了自己的研究成果。他的这项成就让他获得了美国北卡罗来纳大学生物化学副教授的职位邀请。在那里,桑卡又以同样的高标准完成了针对“核苷酸切除修复”机制下一步的研究。和其他研究人员一同——其中也包括托马斯-林道尔,桑卡对人体内的核苷酸切除修复机制进行了研究。紫外线对人体DNA造成损伤的分子机制相比细菌DNA来的更加复杂,但在化学层面上,核苷酸切除修复机制在所有生物体内基本都是一样的。
于是桑卡再次回到了他最初着迷的那个细菌光修复酶上,并揭示了让遭受紫外线照射的细菌恢复活力的背后机制。除此之外,他还帮助展示了人体内相应的光修复酶在帮助我们设定人体生物钟方面的作用。
最后是保罗-莫德里奇。他同样是以一个有关于细胞修复机制的模糊念头开始开展研究工作,但随后他揭示了其背后优美的分子细节。
研究“DNA之类的东西”的回报
保罗-莫德里奇在美国新墨西哥州的一个小城长大。当地的自然景观激发了他对自然界浓厚的兴趣。但有一天,他做生物老师的父亲突然对他说:“你应该去学一点DNA之类的东西。”这时候是1963年,在之前的那一年,詹姆斯-沃森(James Watson)和弗朗西斯-克里克(Francis Crick)刚刚因为发现了DNA分子的双螺旋结构而被授予诺贝尔奖。
多年之后,“DNA之类的东西”真的成为了保罗-莫德里奇生活的中心。在他的研究生涯早期——在斯坦福大学攻读博士研究生,在哈佛大学做博士后研究工作或是在杜克大学担任助理教授,保罗一直在对一系列影响DNA的酶物质:DNA连接酶、DNA聚合酶以及限制性内切酶Eco RI开展研究。到了1970年代末,当保罗将自己的研究兴趣转向Dam甲基化酶时,他一不小心又再次撞进了另外一方面的“DNA之类的东西”,而这些东西接下来将会占据他研究生涯的大部分时光。
研究的交会点
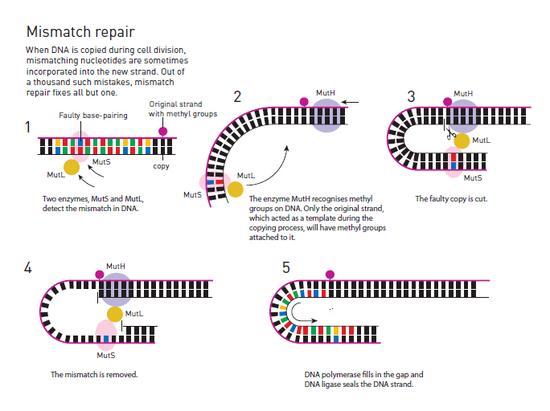
Dam甲基化酶负责DNA与甲基成分的结合。保罗-莫德里奇的研究展示了这些甲基成分可以充当指示牌的作用,从而帮助特定的限制性内切酶咋DNA分子链的正确位置上进行切割。然而就在几年之前,哈佛大学的分子生物学家马修-梅瑟尔森(Matthew Meselson)等人就提出了DNA上甲基的一种不同的信号机制。借助一些分子生物学技巧,梅瑟尔森构建了一种带有数个DNA碱基错误配对的细菌病毒。比如在其碱基配对中,原本应该在A对面是T被改成了C。
当他用这些病毒去感染细菌时,这些被感染的细菌竟然修复了这些碱基配对上的错误。没有人知道为何细菌能够修复这样的错误。但在1976年,梅瑟尔森提出了一种猜想,那就是这其中存在着某种修复机制,能够在DNA信息复制时改正其中的错误。如果事实的确如此,那么或许DNA上的这些甲基能够帮助细菌作出判断——究竟用哪一条DNA分子链作为复制改正的模板。作为一条带有配对错误的新DNA链条,它是没有经过甲基化的,或许这就是正确与错误DNA分子链版本的标志?
正是在这里——针对DNA甲基化的研究方面——保罗-莫德里奇与马修-梅瑟尔森的工作产生了交集。于是两人开始一同工作,他们创造了一种带有数个DNA配对错误的病毒。这一次,莫德里奇的Dam甲基化酶同样也被用来为DNA分子链添加甲基。当用这些病毒感染细菌之后,受感染的细菌改正了那些缺乏甲基的DNA分子链。于是保罗和梅瑟尔森得到结论:DNA配对错误的修正是一种自然过程,其能够在DNA进行复制时修正其中的错误,其原理是通过未经甲基化的DNA链识别存在配对错误的DNA分子链。
保罗-莫德里奇——揭示DNA配对错误修复机制
对于保罗-莫德里奇来说,这一发现是接下来数十年系统性研究工作的开端,在此期间他克隆并研究了一个又一个错误配对修复机制。到了1980年代末,他已经能够在试管中重现复杂的分子修复机制并在极高的细节程度上对这一机制开展研究。他随后在1989年发表了相关工作的结果。
与托马斯-林道尔以及阿奇兹-桑卡一样,保罗-莫德里奇也对人体内的这一修复机制进行了研究。今天我们知道在人体内进行染色体复制时,这种配对错误修正机制起到了关键性的作用。但我们目前仍然不清楚机体是如何识别最初版本的那条染色体链条的。相比于细菌,DNA甲基化在人体内还有其他功能,因此必定还存在其他不同的机制帮助进行这一修复过程,但具体还需要进一步的研究。
DNA修复机制缺陷与癌症的发生
除了碱基切除修复机制、核苷酸切除修复机制以及配对错误修复机制,另外还存在着其他一些种类的DNA修复机制在帮助维护我们DNA的安全。每天它们都会修正数以千计由于太阳照射,吸烟或其他有害物质摄入导致的DNA损坏,对抗每次细胞分裂时出现的DNA自发性突变倾向,在复制阶段,配对修正机制需要修正数以千计的错误配对。
一旦离开这些修复机制,我们的基因组将会崩溃。只要有一处错误发生,遗传信息将迅速发生变化,患上癌症的风险就会大大上升。核苷酸切除修复机制的先天性缺陷会引发“着色性干皮病”。患有这种病的患者对于紫外光照射格外敏感,并会在接受太阳光照射后患上皮肤癌。而DNA复制过程中配对修复机制方面存在的缺陷将增加遗传性结肠癌的发生率,等等。
事实上,在人体患上各种癌症的背后,几乎一定与这些全部或其中一种修复机制被关闭或失效有关。一旦这些DNA修正机制失去应有的作用,癌细胞的DNA就会变得不稳定,这也是为何癌细胞时常会发生变异并变得对化疗免疫的原因。但与此同时,这些患病的细胞甚至比那些健康的细胞更加依赖于这种修复机制。一旦离开了修复机制,它们的DNA将会遭受严重破坏,以至于细胞将会就此死亡。研究人员正在尝试利用这一点开发对抗癌症的新药。
抑制这样的修复机制,我们或许将能够减缓甚至彻底阻止癌细胞的生长。利用这一点来对抗癌症的药物已经开始被研制出来,比如一种名为“olaparib”的药物。
总之,2015年度诺贝尔化学奖所授予的这项基础性研究不仅加深了我们对于自己身体运行机制的认识,也将让我们研制出拯救生命的新型药物。或者,用保罗-莫德里奇的话来说:“这就是为何基于好奇心的研究是如此重要。因为你永远不知道它会把你带向何处。当然,有一点点的好运气也会很有帮助。”(晨风)
[新浪网]